Животът и смъртта традиционно се разглеждат като противоположности. Но появата на нови многоклетъчни форми на живот от клетките на мъртъв организъм въвежда „трето състояние“, което се намира отвъд традиционните граници на живота и смъртта.
Обикновено учените смятат смъртта за необратимо спиране на функционирането на организма като цяло. Въпреки това практики като донорството на органи подчертават как органите, тъканите и клетките могат да продължат да функционират дори след смъртта на даден организъм. Тази устойчивост повдига въпроса: Какви механизми позволяват на определени клетки да продължат да работят, след като организмът е умрял?
Питър Ноубъл (Peter A Noble), професор по микробиология във Вашингтонския университет е ръководител на екип изследователи, които изследват какво се случва в организмите след смъртта им. В техния наскоро публикуван преглед описват как определени клетки – когато са снабдени с хранителни вещества, кислород, биоелектричество или биохимични сигнали – имат способността да се трансформират в многоклетъчни организми с нови функции след смъртта.
Проф. Ноубъл разказва за изследването си в статия на The Conversation.
Живот, смърт и поява на нещо ново
Третото състояние се противопоставя на начина, по който учените обикновено разбират поведението на клетките. Докато гъсениците, преобразуващи се в пеперуди, или поповите лъжички, еволюиращи в жаби, може да са познати трансформации в развитието, има няколко случая, в които организмите се променят по начини, които не са предварително определени. Тумори, органоиди и клетъчни линии, които могат безкрайно да се делят в петриево блюдо, като HeLa клетките, не се смятат за част от третото състояние, защото не развиват нови функции.
Ксеноботите също са в състояние да извършват кинематична саморепликация, което означава, че могат физически да възпроизвеждат своята структура и функция, без да растат. Това се различава от по-често срещаните процеси на репликация, които включват растеж в или върху тялото на организма.
Изследователите са открили също, че отделните човешки белодробни клетки могат да се сглобят в миниатюрни многоклетъчни организми, които могат да се движат. Тези антроботи се държат и са структурирани по нови начини. Те не само са в състояние да се ориентират в заобикалящата ги среда, но също така възстановяват както себе си, така и увредени невронни клетки, намиращи се наблизо.
Взети заедно, тези открития демонстрират присъщата пластичност на клетъчните системи и оспорват идеята, че клетките и организмите могат да се развиват само по предварително определени начини.
Третото състояние показва, че смъртта на организма може да играе важна роля в това как животът се трансформира с течение на времето.
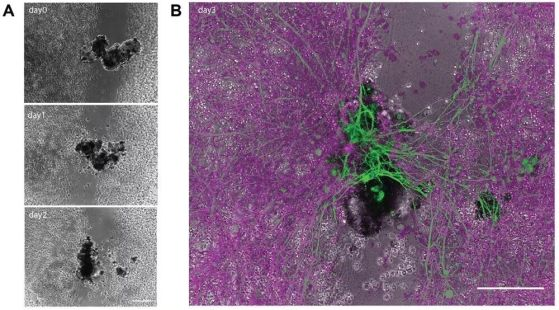
Диаграма A показва антробот, който изгражда мост към сензорен неврон в продължение на три дни. Диаграма B подчертава „бода“ в зелено в края на третия ден. Кредит: Gumuskaya et al. 2023/Advanced Science, CC BY-SA
Посмъртни (Postmortem) условия
Няколко фактора влияят върху това дали определени клетки и тъкани могат да оцелеят и функционират след смъртта на даден организъм. Те включват условия на околната среда, метаболитна активност и техниките за консервация.
Различните видове клетки имат различно време на оцеляване. Например при хората белите кръвни клетки умират между 60 и 86 часа след смъртта на организма. При мишки клетките на скелетните мускули могат да растат 14 дни след смъртта, докато фибробластни клетки от овце и кози могат да бъдат култивирани до един месец след смъртта.
Метаболитната активност играе важна роля за това дали клетките могат да продължат да оцеляват и функционират. Активните клетки, които изискват непрекъснато и значително снабдяване с енергия, за да поддържат своята функция, са по-трудни за култивиране от клетки с по-ниски енергийни изисквания. Техниките за консервация като криоконсервация могат да позволят на тъканни проби като костен мозък да функционират подобно на тези на източници от живи донори.
Присъщите механизми за оцеляване също играят ключова роля за това дали клетките и тъканите продължават да живеят. Например, изследователите са наблюдавали значително увеличение на активността на свързаните със стреса гени и свързаните с имунитета гени след смъртта на организма, което вероятно ще компенсира загубата на хомеостаза. Освен това фактори като наличието на травма, инфекция и времето, изминало след смъртта, значително влияят върху жизнеспособността на тъканите и клетките.
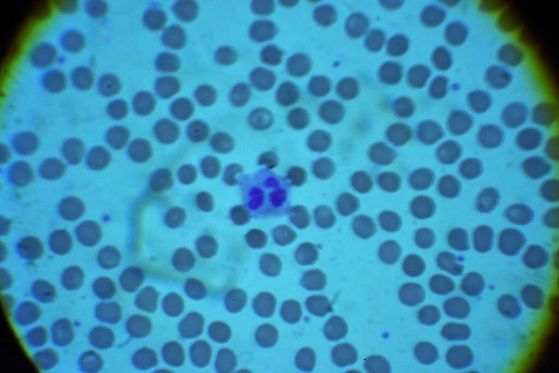
Изображение от микроскоп, показващо една бяла кръвна клетка в средата на кръвна проба. Кредит: U.S. Air Force photo/Staff Sgt. Chuck Broadway/NARA & DVIDS Public Domain Archive
Фактори като възраст, здраве, пол и вид вид допълнително оформят следсмъртните условия. Това се вижда в предизвикателството за култивиране и трансплантиране на метаболитно активни островни клетки, които произвеждат инсулин в панкреаса, от донори към реципиенти. Изследователите смятат, че автоимунните процеси, високите разходи за енергия и влошаването на защитните механизми могат да бъдат причина за множеството неуспешни трансплантации на островни клетки.
Как взаимодействието на тези променливи позволява на определени клетки да продължат да функционират, след като организмът умре, остава неясно.
Една от хипотезите е, че специализирани канали и помпи, вградени във външните мембрани на клетките, служат като сложни електрически вериги. Тези канали и помпи генерират електрически сигнали, които позволяват на клетките да комуникират помежду си и да изпълняват специфични функции като растеж и движение, оформяйки структурата на организма, който формират.
Степента, до която различни видове клетки могат да претърпят трансформация след смъртта, също не е сигурна. Предишни изследвания установяват, че специфични гени, участващи в стреса, имунитета и епигенетичната регулация, се активират след смъртта при мишки, риби зебра (Danio rerio) и хора, което предполага широко разпространен потенциал за трансформация сред различни видове клетки.
Последици за биологията и медицината
Третото състояние не само предлага нови прозрения за адаптивността на клетките. Той също така предлага перспективи за нови лечения.
Например, антроботите могат да бъдат получени от жива тъкан на индивид, за да доставят лекарства, без да предизвикват нежелан имунен отговор. Създадени антроботи, инжектирани в тялото, биха могли потенциално да разтворят артериална плака при пациенти с атеросклероза и да премахнат излишната слуз при пациенти с кистозна фиброза.
Важно е, че тези многоклетъчни организми имат ограничена продължителност на живота, като естествено се разграждат след четири до шест седмици. Този „ключ за спиране“ предотвратява растежа на потенциално инвазивни клетки.
По-доброто разбиране на това как някои клетки продължават да функционират и се трансформират в многоклетъчни клъстери известно време след смъртта на организма е обещаващо за напредъка на персонализираната и превантивна медицина.
The Conversation
Авторът Питър Ноубъл (Peter A Noble) е професор по микробиология във Вашингтонския университет.








